检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
在适应性免疫系统中,由B淋巴细胞产生的多样性的抗体分子是介导体液免疫的关键性效应分子,因此抗体分子的多样性对于适应性免疫是至关重要的。机体在抗原刺激下,B淋巴细胞特异性表达的胞嘧啶脱氨酶AID能够靶向抗体分子产生程序性的DNA损伤,介导抗体类型转换(CSR)以及体细胞高频突变(SHM)的发生,从而产生具有更高亲和力的多样性抗体库。
临床发现AID蛋白的突变与免疫缺陷疾病2型高IgM综合征密切相关,并且这些突变多为隐性遗传,然而有一类C端缺失突变体AIDDC表现为显性失活效应。仍具有胞嘧啶脱氨酶活性的AIDDC由于缺少C端的出核信号而在细胞核内富集,但是却难以介导CSR事件的发生。那么,AIDDC在抗体基因靶点的脱氨酶活性是如何被抑制的呢?以及AIDDC又是如何影响野生型AID的功能从而导致显性失活的呢?这其中的致病机理一直是该研究领域悬而未决的难题。
2022年4月26日,beat365官方网站和北大-清华生命科学联合中心胡家志课题组及其合作团队中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)孟飞龙课题组在The EMBO Journal杂志在线发表题为“C-terminal deletion-induced condensation sequesters AID from IgH targets in immunodeficiency”的研究论文。在这项研究中,研究人员不仅揭示了AIDDC在细胞核内聚集进而导致了AIDDC不能高效的被招募到抗体基因IgH区域;此外,该研究还引入了蛋白质共凝聚的概念,巧妙的阐明了AIDDC突变体通过捕获细胞核内游离的野生型AID形成共凝聚体,从而抑制野生型AID靶向抗体基因的过程,造成显性失活效应的致病机理(Dominant-negative effect;图1)。这也是率先从凝聚体的角度来剖析显性负突变可能的致病机制。
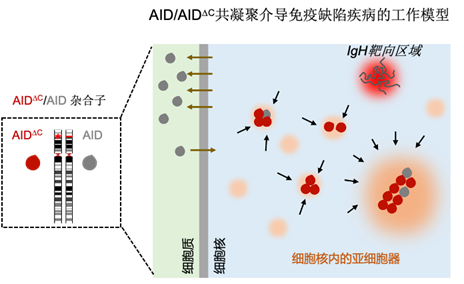
图1. AID/AIDDC共凝聚导致免疫缺陷疾病的工作模型。
在B淋巴细胞内,野生型的AID能够通过自身位于N端的入核信号而进入到细胞质内从而靶向到IgH区域,介导抗体类型转换和体细胞高频突变的发生;而当细胞内含有单个AID的C端缺失突变体AIDDC时,野生型的AID会被AIDDC与其他无膜细胞器共同形成的凝聚体捕获而进入到凝聚体内,因此难以进入到IgH区域介导后续抗体类型转换和体细胞高频突变事件的发生。
研究人员首先通过内源蛋白标记以及CRISPR-Sirius靶向的手段发现AIDDC在B淋巴细胞内以凝聚体的形式存在且这种凝聚体被隔绝在IgH区域之外,失去了靶向抗体基因的能力(图2A)。为了证实这种蛋白凝聚体的形成是导致AIDDC不能起始CSR的原因,研究人员将具有形成凝聚体能力的FUS蛋白偶联在野生型AID的末端,随后发现野生型AID蛋白也具有了形成凝聚体的能力(图2B)。与此同时,这种凝聚体的形成极大的降低了野生型AID-FUS蛋白介导的CSR事件发生频率(图2C)。这表明蛋白凝聚体的形成是导致AIDDC不能靶向抗体基因区域并表现为免疫缺陷的原因。
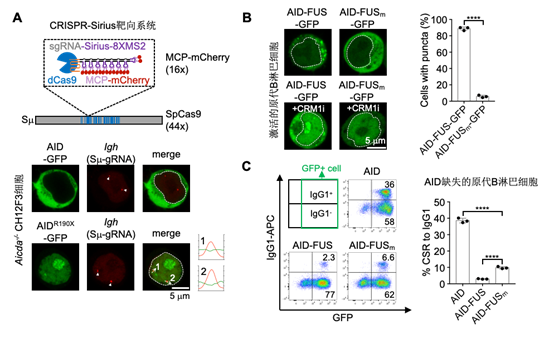
图2. AIDDC形成的凝聚体与IgH区域隔绝从而抑制CSR的发生。
A) 通过CRISPR-Sirius靶向系统标记内源AIDDC-GFP蛋白与抗体靶向基因IgH区域的定位。B) AID-FUS-GFP及其突变体在激活的原代B淋巴细胞内的定位和分布图。C) FACS分析AID-FUS及其突变体介导的抗体类型从IgM转换为IgG1的比例。
通过细胞内共表达实验,研究人员发现AIDDC凝聚体能够特异性的捕获细胞核内游离的野生型AID进入到凝聚体内(图3A)。随后又引入了“optoDroplet”系统验证了AID蛋白N端的12aa序列以及位于AID的催化活性区域的4个精氨酸序列对于AIDDC形成凝聚体十分重要(图3B)。当AIDDC或是其他突变体与野生型AID蛋白共表达时,发现AID/AIDDC凝聚体能够显著降低野生型AID介导抗体类型转换的能力(图3C)。

图3. AID/AIDDC共凝聚导致显性失活效应。
A) 过表达AID及AIDR190X在early G1期的CH12F3细胞中荧光成像,AID与AIDR190X在核内形成共凝聚体。B) AID的N端无序序列和表面正电荷片区具有驱动蛋白凝聚的能力。C) 突变驱动蛋白凝聚的N端序列或表面正电荷片区均可回补AIDR190X引发的显性失活效应。
北京大学胡家志研究员和中科院分子细胞科学卓越创新中心的孟飞龙研究员为文章的共同通讯作者。北京大学生科院的博士后甘婷婷,中科院分子细胞科学卓越创新中心谢霞博士和饶兵博士为文章的共同第一作者;张微微,杨定鹏等亦有重要贡献。此外,该研究还得到了哈佛医学院Frederick Alt院士的支持和帮助。该研究得到了北大-清华生命科学联合中心、科技部国家重大研发计划、国家自然科学基金、细胞增殖与分化教育部重点实验室以及beat365官方网站仪器中心成像以及流式平台的大力支持。
原文链接:https://doi.org/10.15252/embj.2021109324