检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
血液作为生命的河流,源源不断地为机体提供营养物质和免疫保护。作为血液源头的造血干细胞,具有自我更新和多向分化的能力,不仅能够维持机体的终身造血,也是恶性血液疾病移植治疗的重要细胞来源 ADDIN EN.CITE ADDIN EN.CITE.DATA [1, 2]。但是,造血干细胞来源不足却是限制其推广的瓶颈。如何扩增足够数量的功能性造血干细胞,一直是基础科学研究的难点和热点之一。在脊椎动物胚胎发育过程中,胎肝是造血干细胞扩增的天然场所。在这里造血干细胞进行快速的扩增,并能保持较强的干性 ADDIN EN.CITE ADDIN EN.CITE.DATA [3, 4]。全面、系统、立体化地解析这一扩增性造血器官,将为体外扩增造血干细胞提供理论指导。
2021年8月2日,beat365官方网站李程团队与中国科学院动物研究所刘峰团队合作在Cell Research 杂志发表题为Identification of HSC/MPP expansion units in fetal liver by single-cell spatiotemporal transcriptomics的研究论文。该论文利用单细胞转录组和空间转录组联合分析的方法,绘制了小鼠胎肝发育的单细胞时空转录组图谱,解析了造血干/祖细胞的转录组和功能异质性,鉴定了造血干细胞扩增的功能单元(HSC ‘pocket-like’ units, HSC PLUS)并揭示其分子机制。

首先,研究人员通过单细胞转录组测序技术,绘制了胎肝血细胞和微环境细胞发育的转录组图谱,解析了造血干/祖细胞和微环境细胞的转录组动态变化。通过生物信息学分析和移植实验验证,研究人员发现CD93不仅可以富集干性较强的造血干/祖细胞,还是造血干/祖细胞发育的调控因子。随后,研究人员使用CellPhoneDB方法构建了微环境细胞和造血干/祖细胞的互作调控网络,鉴定了潜在的促造血干细胞扩增分子,如生长因子MDK和PTN等。
为了验证互作细胞和配对信号分子的空间关系,研究人员绘制了胎肝的空间转录组图谱。利用空间转录组数据具有空间坐标的特征,研究人员将微环境细胞和与造血干/祖细胞的空间关系分为Intra-spot(关系最密切)、Inter-spot(关系密切)和Others(关系疏远)三类。通过定性和定量分析,研究人员发现巨噬细胞高度富集在造血干/祖细胞周围,并且具有相邻关系的巨噬细胞和造血干/祖细胞分别表达互作分子对中的配体和受体。与此同时,免疫荧光实验数据显示巨噬细胞可以形成“口袋状”结构包围造血干/祖细胞,功能数据显示巨噬细胞及其分泌生长因子的促扩增作用。即扩增的造血干/祖细胞处于巨噬细胞和生长因子富集的HSC PLUS。众所周知,细胞是机体的最小功能单元,其次是组织/器官,本研究发现细胞和组织/器官之间存在细胞行为的特定功能单元,即造血干细胞扩增的基础功能单元(HSC PLUS)。
最后,通过将小鼠胎肝和已发表的人胎肝单细胞转录组数据比对分析,研究人员发现在人胎肝中也存在保守的扩增结构和分子机制。以上述高通量组学数据为基础,研究人员搭建了数据交互网站http://liulab.ioz.ac.cn/fetal_liver/,可以检索基因的时空表达谱,包括细胞类型以及空间位置等。
综上所述,该研究首次绘制了小鼠胎肝发育的单细胞时空转录组图谱,鉴定了造血组织功能单元(HSC PLUS),不仅加深了我们对体内造血干细胞扩增方式的理解,扩充了我们对组织功能单元的认识,也为造血干细胞体外扩增提供了更多线索。
中国科学院动物研究所刘峰研究员和beat365官方网站李程研究员为本文共同通讯作者。中国科学院动物研究所博士研究生高素伟和beat365官方网站石强博士为本文共同第一作者。该研究得到国家自然科学基金、国家重点研发计划等的资助,并得到北京大学“北极星”高性能计算平台的大力支持。
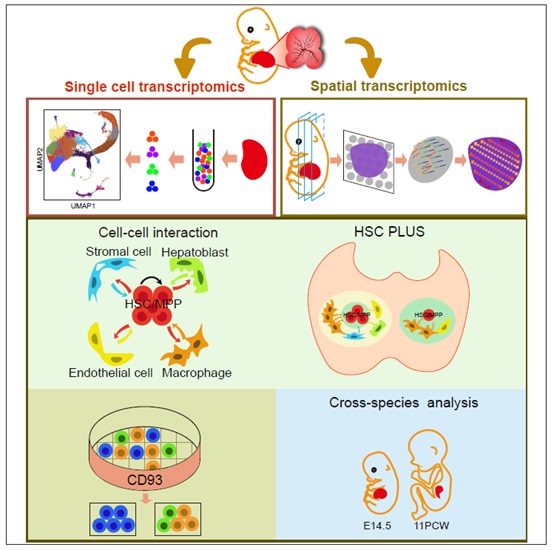
胎肝造血干细胞扩增功能单元示意图
文章链接:https://www.nature.com/articles/s41422-021-00540-7
参考文献
1. Laurenti, E. and B. Gottgens, From haematopoietic stem cells to complex differentiation landscapes. Nature, 2018. 553(7689): p. 418-426.
2. Zhang, Y., et al., Hematopoietic Hierarchy - An Updated Roadmap. Trends Cell Biol, 2018. 28(12): p. 976-986.
3. Ema, H. and H. Nakauchi, Expansion of hematopoietic stem cells in the developing liver of a mouse embryo. Blood, 2000. 95(7): p. 2284-8.
4. Swain, A., et al., Intrinsic and extrinsic regulation of mammalian hematopoiesis in the fetal liver. Histol Histopathol, 2014. 29(9): p. 1077-82.