检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
郑晓峰研究组近日在学术期刊Journal of Biological Chemistry (2019,294(8)2827–2838)上发表了题为“Ribosomal protein L6 (RPL6) is recruited to DNA damage sites in a poly(ADP-ribose) polymerase–dependent manner and regulates the DNA damage response”的研究论文。该研究发现核糖体蛋白RPL6在核糖体作为翻译机器以外的新功能,证明它依赖于ADP核糖基化聚合酶PARP,通过与组蛋白H2A相互作用来调控DNA损伤应答(DDR)的分子机制。
细胞通过DNA损伤应答感应并修复受损的DNA,进而维持基因组稳定性。在DNA双链断裂引起的DDR中,组蛋白H2A及其变体H2AX的泛素化修饰对于下游损伤修复蛋白的招募至关重要。众多调控蛋白通过影响H2A的泛素化调节DNA双链断裂的修复效率,但核糖体蛋白在这一通路中的功能之前尚未有报道。
郑晓峰课题组的研究发现,在DNA双链断裂发生时,RPL6被募集至DNA损伤位点,其与H2A的相互作用随之增强,这一过程依赖于ADP核糖基化聚合酶PARP。RPL6通过增强MDC1与γH2AX间的相互作用促进MDC1在DNA损伤位点的累积,MDC1进一步招募泛素连接酶RNF8和RNF168催化组蛋白H2A于13,15位赖氨酸发生泛素化修饰,泛素化的H2A随后启动对修复蛋白53BP1和BRCA1的招募。RPL6的敲低导致了G2-M检验点的失活,非同源末端连接和同源重组修复效率的降低,以及细胞在依托泊苷处理后存活能力的下降。
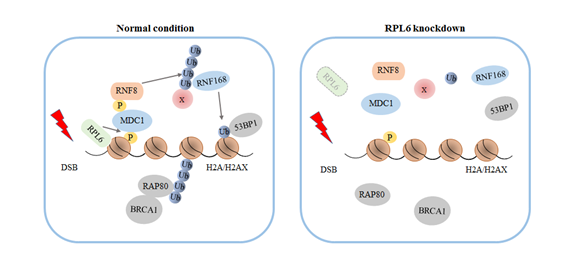
RPL6调控DNA损伤应答模式图
郑晓峰课题组的博士研究生杨传真和臧维成为该论文并列第一作者,该研究得到了国家重点研发科学研究计划、国家自然科学基金、蛋白质与植物基因研究国家重点实验室以及beat365官方网站的支持。
原文链接:http://www.jbc.org/content/early/2018/12/31/jbc.RA118.007009.long