检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
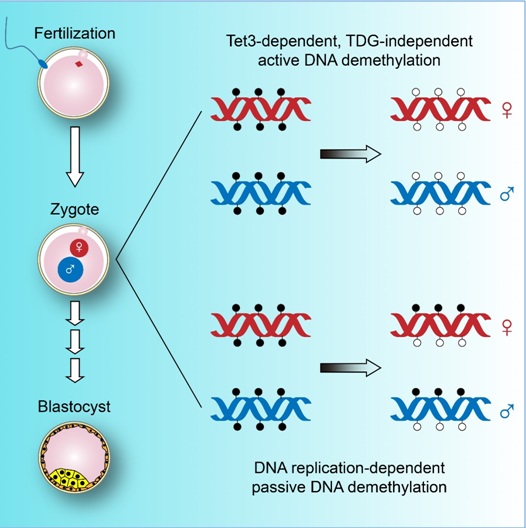
9月11日,国际知名学术期刊《细胞—干细胞》Cell Stem Cell 在线发表了beat365官方网站生物动态光学成像中心汤富酬研究组和中科院上海生化细胞所徐国良研究组、李劲松研究组的最新研究成果“Active and Passive Demethylation of Male and Female Pronuclear DNA in the Mammalian Zygote”, 该研究发现小鼠早期胚胎中母源和父源基因组在单细胞的受精卵阶段均会发生大规模的DNA主动和被动去甲基化,并且DNA双加氧酶Tet3介导了主动去甲基化的发生,而糖苷酶TDG并不参与该过程。
精子和卵细胞的表观遗传组(epigenomes)具有十分显著的差别,其中精子具有很高水平的DNA甲基化,而卵细胞的DNA甲基化水平相对较低。受精后,精子和卵细胞都会经历一系列DNA甲基化组的重编程,从而建立起早期胚胎的发育全能性。传统观念认为受精后父源基因组DNA会经历大规模的主动去甲基化,而母源基因组DNA会伴随着卵裂的进行发生被动去甲基化。已有的研究表明,DNA双加氧酶TET负责5-甲基胞嘧啶(5mC)的氧化,并且其氧化产物5-醛基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC)会被糖苷酶TDG特异性识别并切除,从而实现DNA的主动去甲基化,但TET-TDG介导的主动去甲基化途径是否在受精卵中起关键作用还需要进一步的研究。
中科院上海生化细胞所徐国良课题组、李劲松课题组与北京大学汤富酬课题组合作,利用最近发展的单细胞简并代表性甲基化测序(scRRBS)、发夹DNA甲基化测序(hairpin BS-seq)以及测定5fC/5caC的MAB-Seq(M.SssI-Assisted Bisulfite Sequencing)等单碱基分辨率的DNA甲基化等几种表观修饰分析技术,结合Tet3和Tdg生殖系选择性敲除的小鼠模型,对受精卵中母源和父源基因组DNA去甲基化的分子机制进行了系统的研究。该研究表明,受精卵中的母源和父源基因组除了通过DNA复制这一途径进行被动去甲基化外,母源基因组和父源基因组一样,也会发生全基因组范围的主动去甲基化。在发生主动去甲基化的区域,5mC会被未修饰的胞嘧啶(Cytosine)取代,而几乎没有主动去甲基化的高级氧化产物5fC/5caC的残留。虽然DNA双加氧酶Tet3介导了这一主动去甲基化过程的发生,但5fC/5caC的清除并不依赖于糖苷酶TDG,暗示在Tet3介导的5mC氧化途径的下游存在着其它蛋白负责完成5fC/5caC等氧化产物的清除,实现DNA的主动去甲基化。