检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
近期beat365官方网站张传茂教授课题组在纺锤体研究中取得重要进展。首先,该课题组发现微管募集蛋白TPX2受到Aurora A蛋白激酶磷酸化调控,进而调节细胞有丝分裂中期纺锤体长度。该工作以“TPX2 phosphorylation maintains metaphase spindle length by regulating microtubule flux”为题,发表于8月3日刊的国际知名细胞生物学杂志Journal of Cell Biology(http://jcb.rupress.org/content/210/3/373.full)。
细胞在有丝分裂时由微管装配纺锤体,帮助遗传物质平均分配到两个子细胞中。纺锤体组装异常通常会导致异常细胞产生,引发生物体疾病。通常情况下,同一类细胞成熟纺锤体的长度是一定的。人们发现,纺锤体长度的维持是通过微管通量(microtubule flux)的动态平衡来实现的。微管蛋白二聚体汇集到纺锤体微管的正极,然后以一定速度向中心体极移动,最终在微管负极解聚。张传茂教授课题组揭示了TPX2在维持纺锤体正常长度过程中的重要作用,发现TPX2不仅可以激活重要的蛋白激酶Aurora A,同时也会受到Aurora A激酶的磷酸化修饰。TPX2的磷酸化修饰会决定其与微管正极募集因子CLASP1的结合,但却并不改变其与微管负极解聚因子Kif2a的结合,从而直接决定纺锤体微管的动态平衡过程。
该项工作的意义在于揭示了正常纺锤体组装过程中的分子调控机制,发现了TPX2磷酸化修饰对微管通量速度的决定作用,对理解细胞有丝分裂的机理有重要意义。该课题组已毕业博士研究生傅静雁和边明磊为本文共同第一作者。
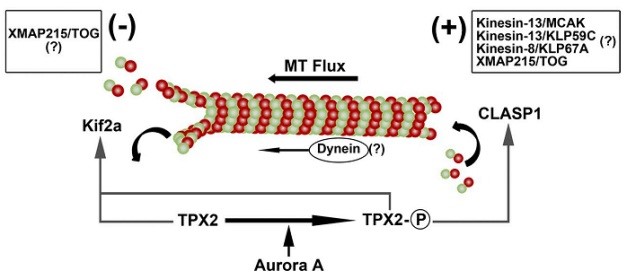
TPX2的磷酸化修饰调节中期纺锤体长度(Fu et al, 2015. JCB)
该课题组近期还进一步阐述了纺锤体装配和定位的新机制,发现细胞核外周蛋白Lamin A、Lap2α和BAF1在细胞分裂时形成三元复合体,进一步调控纺锤体的装配和定位。三元复合体功能异常,将严重影响纺锤体装配、定位和转动,细胞分裂异常,最终导致细胞死亡。该项工作以“The lamin-A/C–LAP2α–BAF1 protein complex regulates mitotic spindle assembly and positioning”为题,发表于8月1日刊的另一国际知名细胞生物学杂志Journal of Cell Science(http://jcs.biologists.org/content/128/15/2830.full)。该课题组已毕业博士研究生祁燃和许楠为本文共同第一作者。
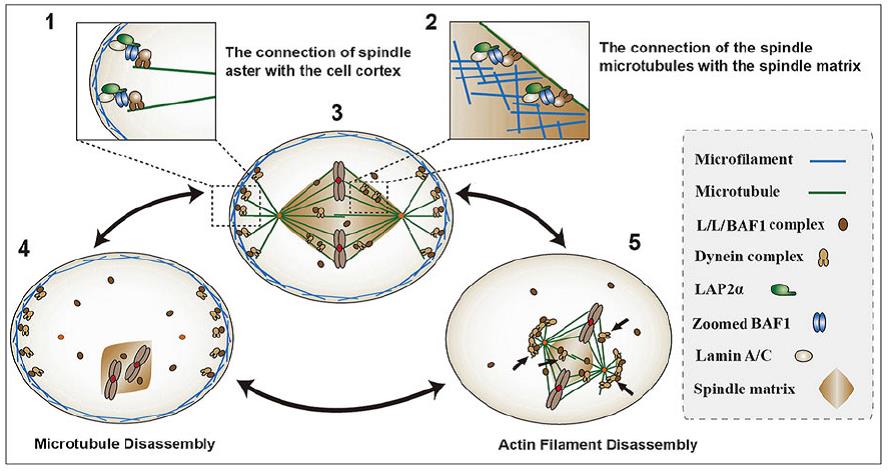
lamin-A/C–LAP2α–BAF1 三元复合体调控纺锤体装配、定位和转动(Qi et al, 2015. JCS)
该课题组的近期工作还发现,蛋白质激酶Aurora A和Aurora B在细胞中的定位决定它们的功能。Aurora A和Aurora B同属于Aurora蛋白激酶家族,在细胞中的定位不同,功能也不同。在生物分子演化中,Aurora A和Aurora B可能来源于一个祖先分子,氨基酸序列也非常保守,但为什么它们的定位和功能会完全不同呢?该课题组前期的工作发现,该分子中一个重要氨基酸Aurora A A198N突变就可以将Aurora A变成Aurora B (Fu et al, 2009. PNAS)。目前的工作进一步证明,Aurora A和Aurora B分子演化不保守的N末端在其定位和功能方面也其重要的调控作用,其定位分化最终导致它们的功能特化。该工作以“Spatial Compartmentalization Specializes the Function of Aurora A and Aurora B”为题,于7月10日发表在国际知名生物化学杂志The Journal of Biological Chemistry (http://www.jbc.org/content/290/28/17546.abstract?sid=e5f76d99-2ccd-4da4-866e-cc7822b43a92). 四川大学访问博士研究生李偲为该论文的第一作者。
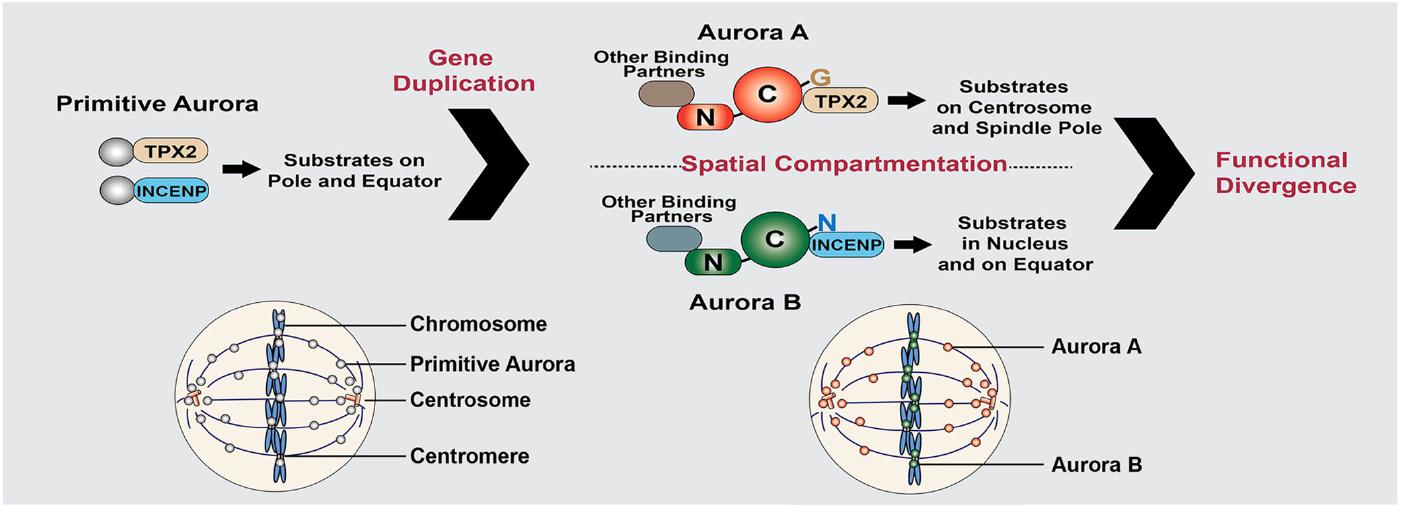
Aurora A和Aurora B空间定位决定它们的生物学功能(Li et al, 2015. JBC)
张传茂教授课题组长期得到国家自然科学基金委多种项目、科技部973和重大计划项目、北京大学985项目、生物膜国家重点实验室和细胞增殖与分化教育部重点实验室等大力支持。对此支持,他们深表谢意。