检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
存在于原核微生物中的固氮酶系统极其复杂,需要一系列,往往十几甚至几十个基因参与调控及其协调表达才能实现其功能。同时,生物固氮过程是一个高能耗的过程,需要消耗大量的ATP和还原力。这些因素都是将固氮酶系统导入植物细胞,实现植物自主固氮所需要面临和解决的难题。
王忆平课题组长期致力于生物固氮的研究。在前期研究中,王忆平课题组将合成生物学方法和理念应用到生物固氮研究中,并已经取得了突破性进展。如,他们成功的以模式微生物大肠杆菌为底盘(Chassis),在大肠杆菌中重构了产酸克雷伯菌(Klebsiella oxytoca)的钼铁固氮酶系统(Wang et al. 2013, PLoS ONE)、棕色固氮菌(Azotobacter vinelandii)的铁铁固氮酶系统,并且证明在不损失固氮酶活的前提下,重组的铁铁固氮酶系统最少只需要10个基因即可在大肠杆菌中固氮(Yang et al. 2014, PNAS)。这两个重构固氮酶系统的建立,为生物固氮研究提供了便捷的遗传操作平台,极大的推进了生物固氮的研究。
鉴于植物不同细胞器往往起源于微生物,国际上普遍认为比较适合将固氮酶系统导入的植物靶细胞器包括叶绿体、白体及线粒体等。因此开展不同固氮酶体系与这些潜在宿主靶细胞器中原有功能元件(Functional Component)之间的适配性研究,是最终实现植物自主固氮的重要步骤。
在本研究中,王忆平课题组首先通过引入了系统生物学以及合成生物学模块化(Modularity)理念,将以上重构的钼铁及铁铁两个固氮酶系统分别划分为三个功能性模块:电子传递链模块(Electron Transport Chain Module)、金属原子簇模块(Metal Cluster Biosynthesis Module)及固氮酶核心模块(“Core” Enzyme Module)。继而运用合成生物手段,在大肠杆菌中重构了植物靶细胞器的电子传递链模块。电子传递链模块替换实验结果表明,来源于植物叶绿体和白体的电子传递链模块能够分别有效的替代钼铁及铁铁固氮酶系统中负责电子传递的原始模块,为这两个固氮酶系统提供底物还原所需的还原力;而来源于植物线粒体的电子传递模块不能为以上两个固氮酶系统提供底物还原所需还原力;进一步研究表明,这一问题可以通过将线粒体来源的电子传递链组分与固氮酶电子传递链组分形成功能性的杂合电子传递链模块而得到解决。该研究成果,一方面解决了固氮酶系统转入植物靶细胞器后,还原力供给的问题;另一方面进一步减少了需要导入植物细胞器的固氮酶系统基因数目(如:铁铁固氮酶系统将最少只需要8个基因)。另外,植物叶绿体中的电子传递链模块为植物光合作用中还原力分配的核心组件,该研究为光合作用和生物固氮相偶联提供了新的思路(见附图),以实现植物自主固氮这一终极目标有着极其重要的指导意义。
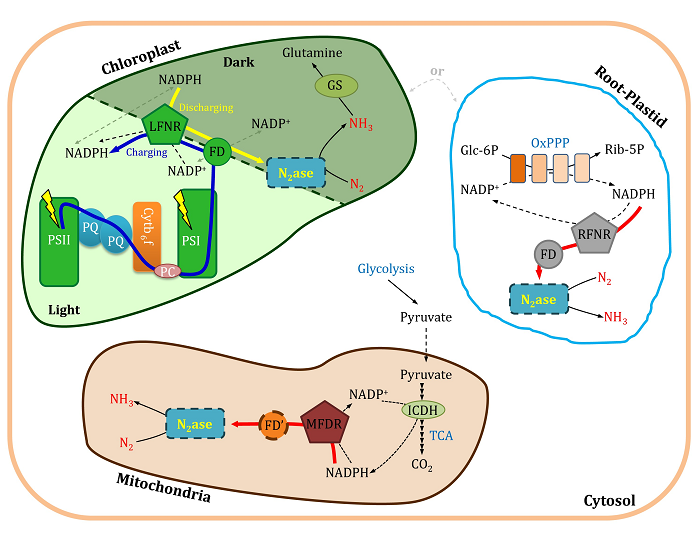
附图: 固氮酶系统导入植物细胞器潜在电子供给示意图。
图内实线标示为植物靶细胞器内固有的组分,虚线标示为外源导入的组分。
该研究以“Modular electron-transport chains from eukaryotic organelles function to support nitrogenase activity”为题,于2017年2月13日以长文形式在线发表在国际知名学术期刊PNAS(美国科学院院刊)。王忆平课题组的博士后杨建国和博士生谢夏青为文章的共同第一作者,英国JIC研究中心Ray Dixon教授和beat365官方网站王忆平教授为该研究论文的共同通讯作者。该研究工作得到了国家自然科学基金,科技部国家973重点基础研究发展计划,蛋白质与植物基因研究国家重点实验室,北大-清华生命科学联合中心,英国生物科学与生物技术研究基金会的资助。