检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2023年9月11日,beat365官方网站李龙研究组在Nature Structural & Molecular Biology杂志上发表题为“Molecular pathway of mitochondrial preprotein import through the TOM-TIM23 supercomplex”的论文。该研究报道了线粒体中介导蛋白质转运的TOM-TIM23超级复合体的结构和生化结果,揭示了蛋白质通过TOM复合物跨越线粒体外膜的新途径,并重新定义了线粒体内膜TIM23转运体复合物的核心组成。
线粒体作为真核细胞中最重要的细胞器之一,在能量供应、胞内代谢、体内平衡和细胞凋亡等过程中都扮演重要的角色。线粒体具有独特的内外双层脂膜结构,内部分布着超过1000种蛋白质。99%的线粒体蛋白质都是由细胞核基因编码,在细胞质的核糖体中合成,并跨膜转运至线粒体中发挥功能。因此,线粒体蛋白质的运输对于维持和调控线粒体的活性至关重要,相关基因的突变与人类许多代谢疾病和癌症的发生密切关联。李龙研究组一直致力于探究线粒体蛋白质进入线粒体的分子机制,已经发表的工作包括解析线粒体膜蛋白通过TIM22转运复合物进入内膜的途径(Zhang Y. et al Cell Research 2021)。此次研究的TOM-TIM23超级复合物在线粒体蛋白转运中的作用更为重要。这个超级复合物由数十种蛋白亚基组装而成,跨越线粒体内外双层膜,控制超过500种线粒体可溶蛋白和膜蛋白的运输。在过去的四十年里,研究人员对TOM和TIM23转运复合物的各个亚基进行了广泛而深入的研究。然而,由于该超级复合物的高度动态性,人们对于这些亚基如何组装形成蛋白质转运通路这一核心问题的了解仍然非常有限,尤其是内膜中的TIM23复合物,其核心转运单元的组成一直很不明确。
在此项研究中,作者首先从组装稳定的TOM-TIM23超级复合物入手,探索多种组装方案,最终选择将绿色荧光蛋白与线粒体蛋白质融合作为转运底物,成功地在酵母细胞内捕获了TOM-TIM23超级复合物转运蛋白质底物的中间状态。经过体外提纯,这种中间态仍然可以稳定存在,用于进一步的结构生物学和生物化学研究。通过冷冻电子显微镜单颗粒分析该中间态,作者发现位于外膜的TOM复合物和位于内膜的TIM23复合物存在直接相互作用,将线粒体内外膜连接起来,从而高效地将蛋白质底物从线粒体外膜向内膜传递 (图1a)。其中,TOM复合物的分辨率解析到了4.1Å,该结构揭示了一条位于Tom40通道亚基内壁上,在各个物种中都很保守的“极性氨基酸路径”,该路径介导蛋白质底物以非折叠的形式通过Tom40的中间孔道 (图1b)。这条路径与之前基于生化实验提出的Tom40中的两条跨膜路径均不相同,显示出TOM复合物在高效识别和转运各种线粒体蛋白质过程中的多能性。
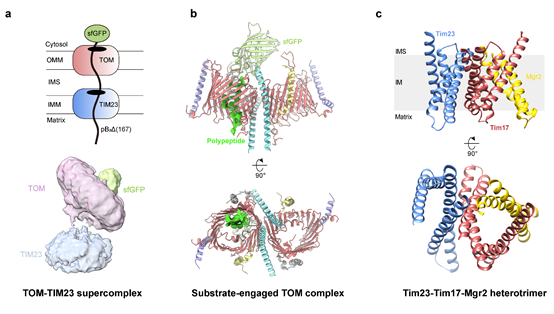
图 1. TOM-TIM23超级复合物的结构。
(a) TOM-TIM23超级复合物的组装示意图和冷冻电镜结构。(b)包含蛋白质底物的TOM复合物的冷冻电镜结构模型。(c) Tim17-Tim23-Mgr2异源三聚体的AlphaFold2结构模型。
此外,作者在蛋白质底物的不同位点系统性地引入非天然氨基酸,利用光交联技术探测了TOM-TIM23的转运通路中蛋白质底物的周围环境,从而鉴定出直接帮助底物跨越两层脂膜的核心亚基。实验结果显示,蛋白质底物的C端片段可以与外膜的Tom40亚基交联,这一结果与结构观测相符。然而,令人意外的是,蛋白质底物的N端片段在内膜中与Tim17和Mgr2两个亚基交联,而不与普遍认定的构成内膜转运通道的Tim23亚基交联。这一结果表明,在过去的研究中,对TIM23复合物核心转运通路的认知可能存在重大偏差。为了进一步确定TIM23中的核心转运亚基及通路,作者综合利用AlphaFold2建模、生化交联、酵母遗传学和线粒体蛋白质体外转运等技术,发现TIM23复合物的核心成分是一个由Tim23、Tim17和Mgr2亚基组成的异源三聚体,其中Tim17和Mgr2面对面形成一个通道状结构,而Tim23以背靠背的形式与Tim17结合,不参与通道的形成 (图1c)。在蛋白转运的过程中,蛋白质底物穿过Tim17和Mgr2形成的通道状结构,不直接与Tim23亚基接触。突变实验发现,在酵母中敲除Mgr2并不影响蛋白质转运,说明在Tim17和Mgr2组成的通道状结构中,只有Tim17是必需的。Tim17之所以可以帮助蛋白质穿过内膜是由于其独特的表面氨基酸分布:一方面,Tim17在内膜入口处有一个高度保守的负电区域,可以破坏局部磷脂双分子层结构,降低蛋白质穿过脂膜的能量势垒;另一方面,在通路的中心,Tim17有一个保守的疏水区域,有助于线粒体内膜保持密闭状态,维持线粒体各项生理活动所需的膜电势。综合各项结构和生化实验结果,可以认定TIM23复合物以Tim17亚基为核心,采取混合模式帮助蛋白质转运,即Tim17可以与其他亚基动态结合形成帮助蛋白质跨膜的通道,或者Tim17以插入酶的工作模式单独完成蛋白质转运,不需要通道的形成。这一结果更正了过去四十年领域内认为Tim23亚基构成核心通道的错误认知。
综上所述,此项研究开发了一套新颖的蛋白转运研究策略,揭示了线粒体蛋白质通过TOM-TIM23超级复合物穿越双层脂膜的关键路径 (图2),颠覆了长期以来领域里对内膜TIM23转运复合物的核心组分的认知,发现了全新的蛋白质转运酶工作模式,为全面深入理解线粒体的生物合成奠定了坚实的基础。
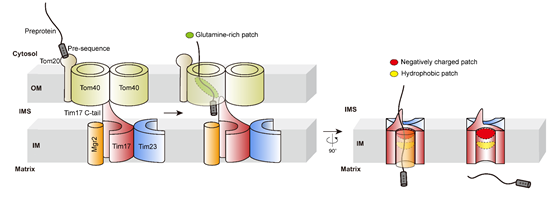
图2. 线粒体TOM-TIM23转运通路。
beat365官方网站李龙研究员为该论文通讯作者,2018级生命科学联合中心博士生周雪垠,2019级beat365官方网站博士生杨玉琪,北京大学冷冻电镜平台王国鹏博士和2020级beat365官方网站博士生王珊珊为共同第一作者。李龙实验室前技术员孙东杰、2022级生科院博士生欧晓敏和2021级生科院博士生连宇珂为该研究工作做出了重要贡献。beat365官方网站高宁教授和李宁宁副研究员、中国科学院生物物理研究所章新政研究员在冷冻电镜数据计算方面提供了极大帮助,beat365官方网站李晴教授和昌增益教授分别对酵母遗传学和光交联实验提供了重要指导。该研究工作得到北京大学冷冻电镜平台、高性能计算中心、生科院仪器中心、以及国家凤凰蛋白质平台的大力支持;获得膜生物学国家重点实验室、北大清华-生命科学联合中心和国家自然科学基金项目的资助。
文章链接:https://www.nature.com/articles/s41594-023-01103-7