检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
人类基因组的非编码序列中,启动子和增强子是调控基因表达的重要功能元件。大多数情况下,激活的增强子会与近端启动子发生直接互作。同时,也存在一部分增强子能够通过染色质成环、蛋白质寡聚化及RNA聚合酶II结合增强子沿染色质追踪等方式与线性基因组中的远端启动子互作来发挥调控功能,增强子与启动子的远距离互作体现了调控元件活性能够影响三维染色质结构。近年来,越来越多的研究表明增强子与启动子互作对于形成特定的三维空间结构至关重要,如转录因子和聚合酶在细胞核中不是均一分布,而倾向于聚集在转录活跃或染色质致密的区域;转录过程如转录延伸也能够影响染色质结构。这些在空间聚集成簇且转录活跃的调控元件是否能够维持大范围染色质结构,目前还没有系统性的研究。
2022年4月7日,北京大学魏文胜课题组与加州大学圣地亚哥分校(UCSD)王巍课题组在Nucleic Acids Research上联合发表了题为 “Regulatory elements can be essential for maintaining broad chromatin organization and cell viability” 的研究论文,该研究基于前期工作中建立的EpiTensor算法(Zhu et al. Nature Communications 2016)发现了基因组中活跃的增强子/启动子互作中心位点,将该类位点称为hotspot。通过CRISPR/Cas9系统对非编码hotspot增强子位点进行靶向片段删除进而进行高通量功能性筛选,发现了一系列位点与细胞生长和存活密切相关。该研究首次发现该类增强子位点的删除能够改变大范围染色质结构,通过同时影响多个非必需基因表达所产生的协同效应来影响细胞稳态。
由于目前能够有效发现增强子/启动子互作的高分辨率Hi-C数据较少,本研究利用分辨率可达200-bp的EpiTensor算法,预测了73个正常细胞系和5个癌细胞系/组织中的活跃增强子/启动子的三维互作,获得了增强子与启动子、增强子与增强子以及启动子与启动子的强烈互作位点hotspot。我们发现该调控元件互作网络(Regulatory element interaction network,REIN)为小世界网络,即对节点的随机破坏不受影响但对于高度值节点的靶向破坏十分敏感(图1A-B)。为了探究hotspot位点是否参与稳定染色质三维结构,该研究利用实验室建立的CRISPR/Cas9系统介导的pgRNA片段删除策略,在K562细胞中对选取的751个非编码hotspot增强子位点进行高通量功能性筛选,发现了43个影响细胞存活或增殖的重要功能区(称为必需hotspot)(图1C)。其中,hotspot_10_25(chr10: 74,123,469–74,1248,68)位点的删除能够导致K562细胞产生显著的细胞死亡或生长抑制,而不影响其他多种癌细胞(图1D)。

图1 hotspot位点的发现及高通量功能性筛选
为了探究hotspot位点删除是否影响染色质结构,该研究选取hotspot_10_25位点进行进一步研究,该位点不与任何必需基因存在互作。Hi-C分析发现该位点删除后其附近6–8 Mb区域的有效直径(effective diameter)和模块化打分(modularity score)发生显著改变,并观察到一些与该hotspot邻近区域发生互作的区域(chr10: 11–17 Mb)也发生改变(图2A-C)。与之相一致地,在chr10: 12–14 Mb区域也发现了拓扑结构相关结构域(TAD)发生破坏。这些染色质结构的改变导致多个基因的增强子与启动子互作发生改变,包括CELF2, RSU1, FAM149B1和CCAR1等(图2D),这些被影响的增强子和启动子并不局限于被删除的hotspot位点附近,甚至可以远达62 Mb。由此表明,hotspot位点的删除可以影响大范围染色质结构,而不限于其线性基因组的邻近区域。单细胞测序进一步发现,该hotspot位点的删除会激活一系列细胞凋亡相关基因的表达,并且可以同时影响TAD内与之存在互作的多个非必需基因的表达,研究证明多基因表达改变的协同效应能够显著影响细胞存活(图2E)。该研究首次揭示了非编码调控元件增强子在稳定染色质三维结构中的重要性,而不局限于已知的通过增强子与启动子的直接互作来进行调控。
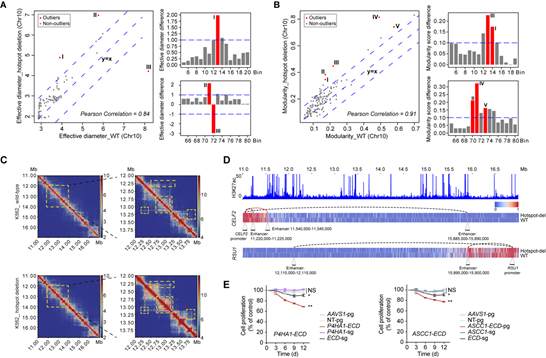
图2 hotspot位点删除导致大范围三维染色质结构和多基因表达的同时改变
值得一提的是,2021年11月UCSD王巍和北京大学魏文胜两个课题组合作在Science Advances上首次报道了无任何表观遗传信号的非编码位点hub能够稳定染色质三维结构并维持细胞存活(Ding et al., Science Advances 2021)。通过对hub和hotspot这两类非编码位点进行系统性挖掘、高通量筛选及深入功能解析,将进一步丰富对基因组非编码区域的功能阐述,并逐步揭示其在维持三维基因组结构中的重要作用。
北京大学刘莹博士、加州大学圣地亚哥分校丁博博士、博士生郑丽娜和北京大学许萍博士为该论文的共同第一作者,北京大学魏文胜教授和加州大学圣地亚哥分校王巍教授为该论文的共同通讯作者。该研究项目得到了国家自然科学基金、北京市科委生命科学前沿创新培育项目、北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心、中国博士后科学基金、加州再生医学研究所(CIRM)以及美国国立卫生研究院(NIH)的支持。