检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
CRISPR-Cas核酸酶是目前最为广泛使用的基因编辑工具,在基础科研以及临床应用方面都有着广阔的应用前景。除脱靶活性以外,CRISPR-Cas核酸酶编辑基因组可能产生染色体易位以及染色体大片段缺失等异常结构,这将严重威胁基因组的稳定性,并与癌症的发生相关。因此染色体结构异常成为CRISPR-Cas应用的一大障碍。美国国立卫生研究院NIH于2021年在Nature上撰文强烈呼吁关注基因编辑过程中染色体结构异常的产生,并寻求领域内研究者开发相应的检测方法1。最近美国FDA暂停了Allogene Therapeutics开发的CAR-T细胞疗法的临床研究,原因是在一例患者体内发现了由基因编辑导致的可能引发癌症发生的染色体易位。染色体结构异常在基因编辑过程中的发生概率仅百分之几,属于基因编辑中的小概率事件,然而随着基因编辑临床应用的不断普及,被编辑细胞出现不可控染色体易位等的病人的数量也必然会将逐渐增加。而由于缺乏针对基因编辑过程中染色体结构异常发生机制的了解,领域内尚没有抑制该类副产物发生的有效策略。
2022年3月8日,beat365官方网站、北大-清华生命科学联合中心胡家志课题组及合作者在Nature Communications上发表了题为Cas9 exo-endonuclease eliminates chromosomal translocations during genome editing的研究文章,揭示了基因编辑过程中染色体易位产生的分子机制,并针对性地设计和开发了安全性大幅提高的新型基因编辑酶Cas9TX。Cas9TX能抑制基因编辑过程中染色体易位、大片段缺失等染色体结构异常的产生,将CRISPR-Cas9基因编辑的安全性大大提高,其编辑过程中的DNA损伤被降低到与目前被认为最安全的碱基编辑器(Base Editor)相当的水平。Cas9TX可能是目前最为安全的CRISPR-Cas9编辑变体。
基于胡家志课题组2019年开发的全面评估基因编辑安全性的方法PEM-seq (Primer-extension-mediated sequencing2,作者首先评估了新一代CAR-T技术的安全性。PEM-seq方法的详细操作指南也于2022年公开发表于Cell系列的杂志STAR protocols上(https://doi.org/10.1016/j.xpro.2021.101088)3。新一代CAR-T细胞的构建结合了基因编辑技术,在生产CAR-T细胞的同时敲除TRAC,B2M,PDCD1等多个基因,可降低供体与受体之间的免疫排斥反应,实现异体移植的可能,并同时提高CAR-T细胞的杀伤能力。在本研究中,作者首先利用PEM-seq检测了新一代CAR-T细胞中染色体结构异常的发生概率,分析表明染色体易位普遍发生于多个Cas9的靶向位点之间,其比例占到了总编辑事件的1%左右。这意味着在CAR-T细胞疗法中,每给病人回输10^8个CAR-T细胞便有多于10^6个细胞携带染色体易位。而值得注意的是,以往的关于淋巴瘤的研究表明,TRAC附近存在可以大幅促进基因表达的转录增强子,可以提升易位后附近原癌基因的表达水平(如北京大学吴虹教授最近发表的工作:https://www.nature.com/articles/s41467-021-24044-5)4。该研究进一步指出目前领域内常用于消除脱靶活性的Cas9高保真变体并不能有效抑制Cas9靶向位点之间染色体易位的发生(图一)。
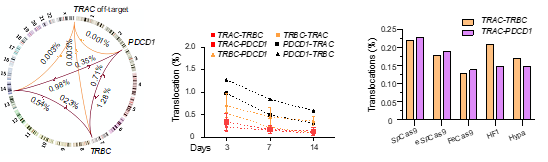
图一. 染色体易位普遍存在于新一代CAR-T细胞制作过程中
为了探究基因编辑过程中染色体易位发生的规律,该研究对PEM-seq数据进行了详细的分析,作者意外地发现Cas9靶向位点与脱靶位点两端发生的易位连接存在着明显的方向偏好性(bias)。按理DNA发生切割后两种末端应该是随机结合的,不具有偏好性,而实际上的末端结合偏离了理论值1:1的比例(图二上)。通过这样一个“真奇怪”的发现(注:艾萨克阿西莫夫曾说,在科学探索中能听到的最激动人心、可能预示着新发现的一句话,不是“我找到了”,而是“真奇怪”。),作者找到了基因编辑过程中染色体易位大量发生的主要原因之一,即Cas9在靶位点和脱靶位点上的反复切割(repeated cleavage)(图二下)。这一机制的发现也解决了困扰Fred Alt等实验室近十年之久的一个问题:为何G1晚期的细胞比生长中的细胞更容易形成染色体易位?
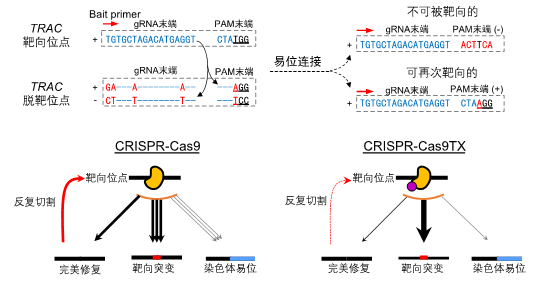
图二. Cas9反复切割完美修复产物导致了染色体易位的大幅度产生
随后作者尝试将核酸外切酶与Cas9相偶联,通过在编辑过程中修饰DNA断裂末端来减少完美修复产物的比例,从而抑制Cas9反复切割(图二下)。通过对多种外切酶的筛选,本研究最终将优化过的人源TREX2蛋白与Cas9相偶联生成核酸内外切酶Cas9TX,PEM-seq分析显示Cas9TX确实可以抑制Cas9反复切割,并几乎消除了染色体易位的产生。接着作者通过全基因测序等手段验证了Cas9TX并不会对基因组造成非特异性的切割,它可以稳定、有效地抑制消除染色体易位的产生,并达到了与造成DNA单链断裂的碱基编辑器同等的水平。另外研究人员发现Cas9TX还可大幅度减少染色体大片段缺失的生成。与此同时,在抑制染色质结构异常发生的同时,Cas9TX还能保持与Cas9同水平或者略高的基因编辑水平。另值得指出的是,突变的TREX2仅236个氨基酸,不会显著增加Cas9的大小(图三)。
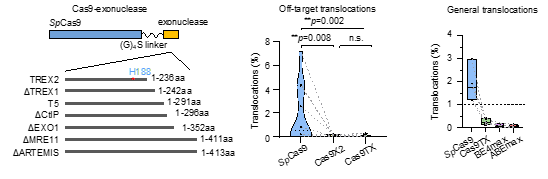
图三. Cas9TX几乎消除了基因编辑过程中染色体易位的产生
作者进一步将Cas9TX应用于新一代CAR-T细胞的制备,发现在不影响CAR-T杀伤效果的同时,Cas9TX将靶向位点之间的染色体易位降低到了背景水平。总之,Cas9TX展现出了惊人的效果。
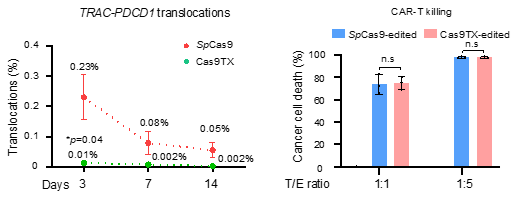
图四. Cas9TX提高CAR-T细胞制作的安全性
北京大学胡家志研究员为该文章的通讯作者。该研究得到了北京大学医学部刘涛,北京大学李湘盈,魏平研究员以及北京大学第一医院妇产儿童医院妇科肖冰冰医生的大力支持。胡家志研究员实验室博士研究生尹健行,卢如森以及辛昌昌为该文章的共同第一作者,该文章也得了其他共同作者的大力帮助。该工作得到了科技部、国家自然科学基金、细胞增殖与分化教育部重点实验室、北大-清华生命科学联合中心以及北京大学临床医学+X 专项科研基金的资助。
原文链接:https://www.nature.com/articles/s41467-022-28900-w
参考文献
1 Saha, K. et al. The NIH Somatic Cell Genome Editing program. Nature 592, 195-204, doi:10.1038/s41586-021-03191-1 (2021).
2 Yin, J. et al. Optimizing genome editing strategy by primer-extension-mediated sequencing. Cell Discov 5, 18, doi:10.1038/s41421-019-0088-8 (2019).
3 Yang Liu, J. Y., Tingting Gan, Mengzhu Liu, Changchang Xin, Weiwei Zhang, and Jiazhi Hu. PEM-seq comprehensively quantifies DNA repair outcomes during gene-editing and DSB repair. STAR Protocols 3, doi:https://doi.org/10.1016/j.xpro.2021.101088 (2022).
4 Yang, L. et al. 3D genome alterations associated with dysregulated HOXA13 expression in high-risk T-lineage acute lymphoblastic leukemia. Nat Commun 12, 3708, doi:10.1038/s41467-021-24044-5 (2021).