检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
脂肪肝病是多数人眼中营养过剩造成的一种“富贵病”。事实上,消瘦的脂肪肝病患者也很多,占脂肪肝病患者总数的20%【1】。早在1929年,儿科医师西塞莉·威廉姆斯(Cicely Williams)就发现,加纳沿海地区的许多婴儿会由于提前断奶而患上营养不良症,尽管这些患病儿童瘦骨嶙峋,却往往患有严重的脂肪肝病【2,3】。除了营养不良症的患病儿童,神经性厌食症(anorexia nervosa)的患者也饱受脂肪肝病的困扰【4】。更加令人诧异的是,依赖禁食实现快速减肥的人群中,脂肪肝病的发病比例也会显著高于健康人群。那么,为什么营养过剩的肥胖人群和营养不良的消瘦人群都会出现脂肪肝病呢?
“当我们感到迷茫,果蝇总能指引我们前进的方向。”正如2017年诺贝尔生理学或医学奖获得者迈克尔·杨(Michael Young)所说,“是果蝇让我们一次又一次踏上正确的道路。纵使演化的巨轮滚滚向前,我们依然能够从果蝇身上捕捉到哺乳动物乃至人类的影子。”全基因组测序结果表明,黑腹果蝇(Drosophila melanogaster)与人类基因组的同源程度高达60%,涵盖77%的人类遗传病致病基因,是理想的疾病模型【5】。果蝇幼虫绛色细胞(oenocyte)与人类的肝细胞高度类似,在饥饿刺激下也会积累大量的脂滴,模拟了人类的脂肪肝病【6】,为理解营养不良造成脂肪肝病的临床表现提供了理想的切入点。正是基于上述同源特性,以及果蝇遗传学的强大优势,绛色细胞为营养不良造成脂肪肝病的分子机制研究提供了理想的研究系统。那么,我们能否利用果蝇研究肝细胞的饥饿响应机制,回答为什么营养不良会导致脂肪肝病这个问题呢?
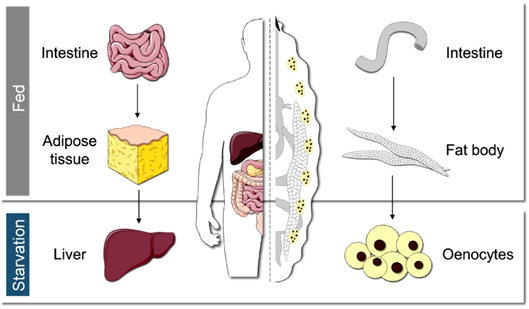
图1. 人类(左)和果蝇(右)的脂质代谢调控示意图
2022年3月3日,beat365官方网站、北大-清华生命科学联合中心朱健课题组在 Molecular Cell 在线发表了题为 Amelioration of hepatic steatosis by dietary essential amino acid-induced ubiquitination 的研究论文。利用果蝇幼虫绛色细胞作为研究系统,他们发现必需氨基酸摄入不足是造成营养不良人群患上脂肪肝病的“罪魁祸首”。当必需氨基酸匮乏时,肝细胞中的 E3 泛素连接酶 Ubr1 会失活,不能催化脂滴保护蛋白 Plin2 的多聚泛素化降解。Plin2 蛋白水平的升高则会抑制肝脏脂肪的分解,从而造成脂肪肝病。

朱健课题组发现,Ubr1 是肝细胞中重要的必需氨基酸受体,但与已知的氨基酸结合蛋白不同【7】,它能够区分必需氨基酸和非必需氨基酸。7种必需氨基酸(精氨酸、赖氨酸、组氨酸、亮氨酸、异亮氨酸、色氨酸和苯丙氨酸)能够直接结合并激活 Ubr1,促使其催化底物 Plin2 的泛素化降解,从而缓解肝细胞中的脂肪积累。作为两种支链氨基酸,亮氨酸和异亮氨酸激活 Ubr1 的能力最强。在食物中添加亮氨酸或异亮氨酸,能够显著提升果蝇幼虫对饥饿条件下绛色细胞中脂肪积累的抵抗能力。因此,对于营养不良人群而言,适量补充必需氨基酸,尤其是支链氨基酸,对脂肪肝病的预防具有重要的指导意义。
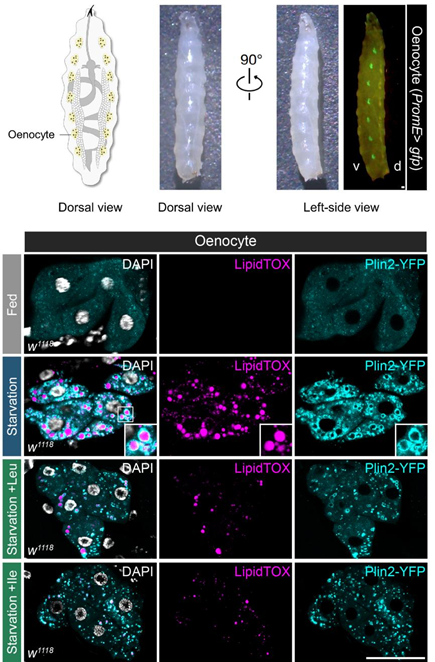
图2. 亮氨酸和异亮氨酸能够提升果蝇幼虫抵御绛色细胞中脂肪积累的能力
作为目前世界范围内发病率最高的慢性肝病,脂肪肝病严重威胁着人类的生命健康。尽管耗费了大量的人力物力财力,目前仍然没有任何一款脂肪肝病的治疗药物获批上市。那么,是否能够通过激活 Ubr1 实现脂肪肝病的治疗呢?朱健课题组发现,必需氨基酸对 Ubr1 的激活依赖于其自抑制作用的解除。通过解除 Ubr1 的自抑制作用,他们构建了持续激活形式的 Ubr1 突变体。在没有氨基酸结合的情况下,持续激活形式的 Ubr1 突变体也能够高效地催化 Plin2 的泛素化降解,显著改善因氨基酸摄入不足造成的脂肪肝病。值得一提的是,通过对分离内含肽(split-intein)技术的改进,他们在小鼠肝脏中实现了持续激活形式的 Ubr1 突变体蛋白的重组表达。在2周时间内,持续激活形式 Ubr1 突变体的表达能够显著改善肥胖或高脂饮食导致的脂肪肝病,促使小鼠肝脏脂肪含量减少40%以上。因此,激活 Ubr1 可以作为脂肪肝病潜在的治疗策略,能够特异性结合并激活 Ubr1 的脂溶性小分子有望成为治疗脂肪肝病的特效药。
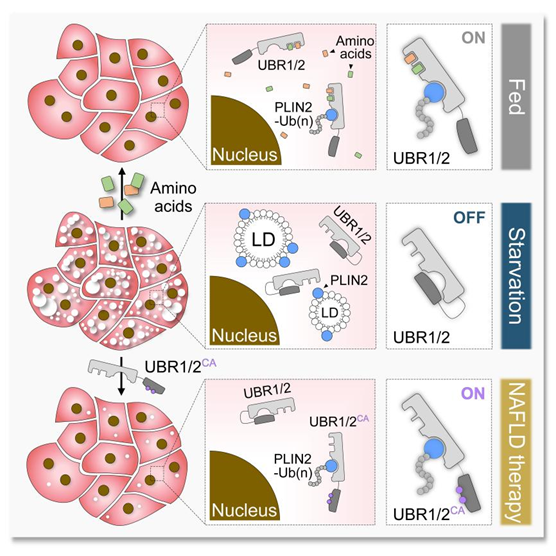
图3. 必需氨基酸改善脂肪肝病的分子机制示意图
beat365官方网站博士研究生张延松、清华大学生命科学联合中心博士研究生林思远和beat365官方网站本科生彭靖予(现已毕业)是该论文的共同第一作者,beat365官方网站朱健研究员和刘敏副研究员是本文的共同通讯作者。该研究得到了beat365官方网站张哲课题组的大力帮助。该项目获得科技部、国家自然科学基金、细胞增殖与分化教育部重点实验室、北大-清华生命科学联合中心以及beat365官方网站启东产业创新基金的资助。
文章链接:https://doi.org/10.1016/j.molcel.2022.01.021
参考文献
1. Francque, S., and Wong, V.W. (2022). NAFLD in lean individuals: not a benign disease. Gut 71, 234-236.
2. Williams, C.D. (1933). A nutritional disease of childhood associated with a maize diet. Arch. Dis. Child. 8, 423-433.
3. Hughes, W. (1945). Fatty liver and malignant malnutrition. The Lancet 246, 861-862.
4. Fontana, L., and Partridge, L. (2015). Promoting health and longevity through diet: from model organisms to humans. Cell 161, 106-118.
5. Bilder, D., Ong, K., Hsi, T.C., Adiga, K., and Kim, J. (2021). Tumour-host interactions through the lens of Drosophila. Nat. Rev. Cancer 21, 687-700.
6. Gutierrez, E., Wiggins, D., Fielding, B., and Gould, A.P. (2007). Specialized hepatocyte-like cells regulate Drosophila lipid metabolism. Nature 445, 275-280.
7. Efeyan, A., Comb, W.C., and Sabatini, D.M. (2015). Nutrient-sensing mechanisms and pathways. Nature 517, 302-310.