检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2021 年 6 月 10 日,beat365官方网站孔道春实验室在美国科学院期刊 PNAS 在线发表了题为“The intra-S phase checkpoint directly regulates replication elongation to preserve the integrity of stalled replisomes” 的 研 究 论 文(https://www.pnas.org/content/118/24/e2019183118)。该研究回答了过去50 年在 checkpoint(细胞周期检验点)调控维持真核细胞 DNA 复制叉稳定领域的两个核心问题:1)停顿的 DNA 复制叉为什么会不稳定,并倾向于垮塌;2)checkpoint 调控维持停顿复制叉稳定的核心分子机制是什么?
正常细胞生长过程中,基因组不稳定主要是来自于 DNA 复制错误,大约 2/3 癌症的发生被认为是由于 DNA 复制错误导致的(Tomasetti & Vogelstein (2015), Science, 347: 78-81; Tomasetti et al. (2017), Science, 355: 1330-1334),而 DNA 复制错误主要是来自于 DNA 复制叉的不稳定。DNA 复制叉主要由两部分构成(图 1):Y 字型的 DNA 结构和 DNA 复制体 (Replisome)。DNA 复制体包含一系列与复制相关的蛋白质及蛋白质复合物,其中,最重要的是打开双链 DNA 模板的 CMG(Cdc45-MCM-GINS)解旋酶复合物,以及进行新生链 DNA 合成的 DNA 聚合酶--DNA Pol α、δ、ε 。正常移动的DNA 复制叉是相对稳定的,DNA 复制体中的 CMG 解旋酶与 DNA 聚合酶在物理及生化功能上紧密偶联。但当 DNA 复制叉遭遇复制障碍停顿下来时,停顿的 DNA 复制叉被证明是不稳定的,倾向于垮塌。
上个世纪 60 年代末,在裂殖酵母里筛选到了一株突变株,命名为 rad3-136。很快发现 rad3-136 突变株对羟基脲(Hydroxyurea (HU), 抑制 dNTPs 合成,导致 DNA 复制叉停顿)高度敏感。至此,细胞维持停顿 DNA 复制叉稳定的机制研究拉开了序幕。Rad3 及相关蛋白介导的细胞调控,于 1988 年被命名为 checkpoint 调控(Weinert & Hartwell (1988), Science, 241: 317-322), Rad3 被归类为 ATR 激酶。过去 50 年,前后上千个实验室,用两代人的时间,发表了上万篇研究文章,证明 checkpoint 是维持停顿DNA 复制叉稳定的必需细胞调控。在checkpoint 缺失或缺陷的细胞,停顿的DNA 复制叉发生垮塌,导致 DNA 复制不能完成,及基因组的极度不稳定。但是,在试图阐明checkpoint 调控维持 DNA 复制叉稳定的机制研究方面,碰到了极大阻力,阻力主要是来自于 checkpoint 调控的靶蛋白极难被确定,已发表文章的结论也互相矛盾,导致checkpoint 调控维持 DNA 复制叉稳定的核心机制长期得不到确定。
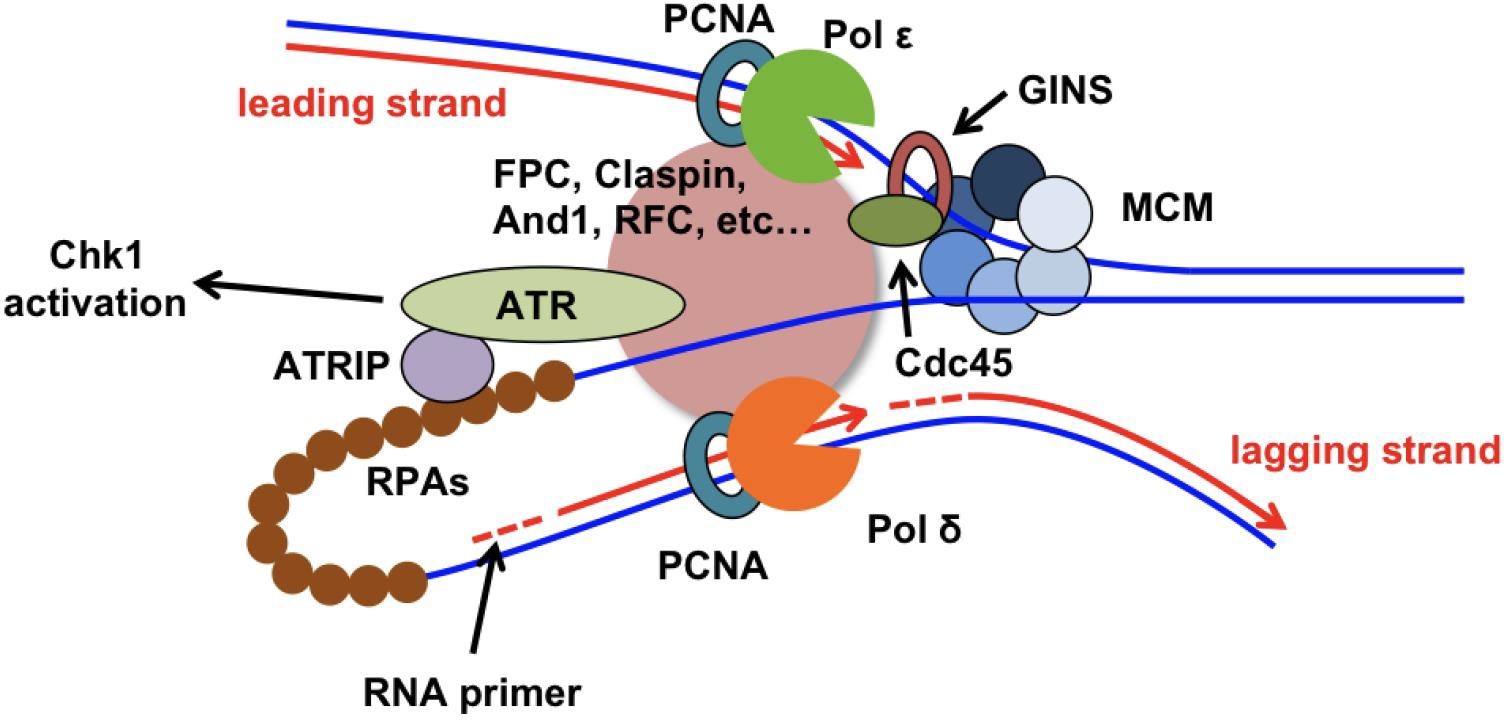
图 1 真核细胞 DNA 复制叉及 S 期细胞周期检验点(Leman AR, Noguchi E. The replication fork: understanding the eukaryotic replication machinery and the challenges to genome duplication. Genes. 2013 Mar;4(1):1-32.)。酵母 Chk2 在高等真核生物的功能同源蛋白是 Chk1。
通过大规模的遗传筛选,孔道春实验室发现,复制解旋酶 CMG(Cdc45-MCM- GINS)复合体的一个亚基 Cdc45 的突变能极大降低(600-3000 倍)checkpoint 通路缺陷的细胞对 HU 的敏感性,暗示 Cdc45 或 CMG 复合体可能被 checkpoint 调控。然后, 通过一系列遗传及生化分析,证明 Rad3ATR-Cds1Chk2 checkpoint 通路直接调控 DNA 复 制解旋酶 CMG 复合体。孔道春实验室发现:当 DNA 复制叉停顿后,Cds1Chk2 同时磷酸化 Cdc45 亚基上的三个丝氨酸残基(且这三个 Chk2/Chk1 磷酸化位点在不同物种中相对保守)。这三个丝氨酸残基的磷酸化导致 CMG 复制解旋酶活性深度降低。CMG 复制解旋酶活性的降低使得它不能脱离停顿复制叉,不能与被阻挡的DNA 聚合酶分开。这样,停顿的 DNA 复制体(Replisome)及复制叉的生化完整性得到了维持,从而阻止了停顿 DNA 复制叉的垮塌。
为什么停顿复制叉里的复制解旋酶与DNA 聚合酶会倾向于分开呢?这关联到两件事情:一是 DNA 复制体或 DNA 复制叉的基本生化特性;二是正常细胞生长过程中导致复制叉停顿的基本原因。DNA 复制体中,DNA Pol ε 负责合成前导链 (leading strand)合成, DNA Pol α 和 δ 负责后随链(lagging strand)合成。由于后随链的合成稍微滞后于 CMG 解旋酶介导的 DNA 链解开,导致后随链的 DNA 模板上恒定的出现一段约 200 核苷酸长度的单链DNA 区域。如果该单链DNA 区域有形成DNA 二级结构的序列,如 G4、三股链、发夹结构等,DNA 二级结构的形成就是一个大概率事件。形成的 DNA 二级结构会阻挡 DNA Pol α、δ 的移动,导致复制叉停顿。在酵母细胞的染色体 DNA 上,大约有 2000-4000 个能形成 DNA 二级结构的序列。在人细胞中,能形成DNA 二级结构的数目大约有数百万个(~75 万个 G4 结构,及数倍于G4 的三股链结构等)。因此,DNA 二级结构导致的复制叉停顿是一个经常发生的生物事件。在前导链或后随链的DNA 模板上, 如果有碱基损伤(每个人细胞每天有约 105 级别的这类损伤) 或化学修饰,也会阻挡 DNA Pol α、δ、ε(DNA 聚合酶的活性中心非常精巧,只能容纳 AT 或 GC 配对,但不能容纳 AC 或 GT 配对,以保证DNA 复制的精准性),导致复制叉停顿。当DNA 聚合酶被阻挡后,CMG 解旋酶还要往前移动,这样就会导致CMG 解旋酶与 DNA 聚合酶物理上的分开,导致复制叉垮塌。
经过上千个实验室 50 年的不懈努力,checkpoint 调控维持停顿DNA 复制叉稳定的核心机制最终得到了阐明。即,1)停顿复制叉不稳定、倾向于垮塌的根本原因是: 当 DNA 聚合酶被阻挡后,复制解旋酶与 DNA 聚合酶倾向于分开;2)checkpoint 调控维持停顿复制叉稳定的核心机制是:降低复制解旋酶的活性,阻止复制解旋酶脱离复制叉 或 DNA 聚合酶,维持两者之间在物理及生化功能上的紧密偶联,从而维持停顿复制叉稳定, 并保持它的生物学功能(图 2)。孔道春实验室于 2019 年发现的chromsfork 调控,通过提高停顿复制叉周围的染色质结构紧密程度,也是为了阻挡复制解旋酶脱离复制叉,以维持复制叉稳定 (Feng et al. (2019), PNAS, 116(29):14563- 14572)。
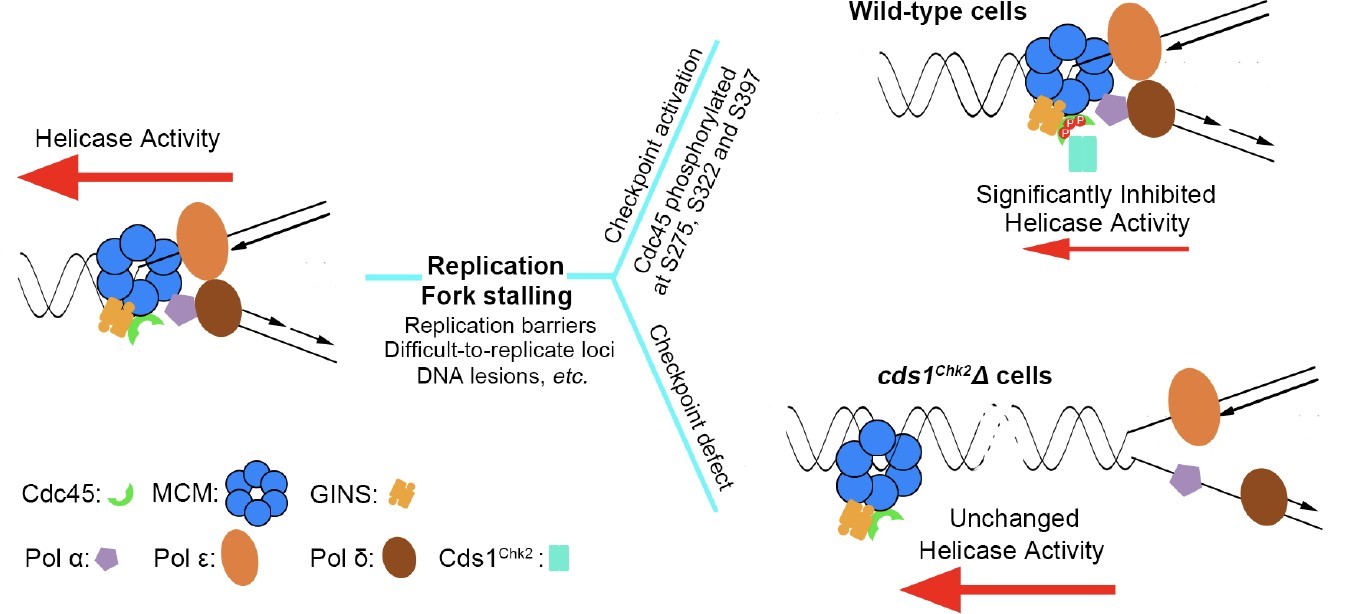
图 2. Cds1Chk2 磷酸化复制解旋酶CMG 里的Cdc45 亚基,深度降低复制解旋酶活性,阻止复制解旋酶与 DNA 聚合酶分开,从而稳定停顿复制叉。
孔道春教授为该论文的通讯作者。刘阳博士和王露(2015 级博士研究生)为该论文的共同第一作者。许鑫、袁越、张波、李泽阳、谢雨晨、闫睿、郑泽琦、beat365官方网站纪建国教授、英国 Sussex 大学的 Johanne M. Murray 和 Antony M. Carr 教授也对本研究作出重要贡献。感谢实验室所有成员的帮助。本工作得到了北大-清华生命科学联合中心、科技部国家重点研发计划、国家自然科学基金委、蛋白质与植物基因研究国家重点实验室、以及beat365官方网站仪器中心(成像平台及流式平台)的大力支持,在此,表示衷心感谢。