检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
近日Cell Death & Differentiation期刊在线发表了beat365官方网站郑晓峰研究组的题为“Deubiquitinating enzyme OTUB1 promotes cancer cell immunosuppression via preventing ER-associated degradation of immune checkpoint protein PD-L1” 的长篇研究文章。该研究发现去泛素化酶OTUB1通过调控免疫检查点蛋白PD-L1的泛素化修饰来抑制PD-L1在内质网的降解,揭示了OTUB1-PD-L1信号途径在调节肿瘤细胞免疫逃逸中的关键作用,表明特异性抑制OTUB1的活性和功能可能成为肿瘤免疫治疗的潜在靶标。
程序性死亡配体1(PD-L1)和受体分子PD-1是免疫检查点阻断治疗中的重要靶点。肿瘤细胞表面高表达的PD-L1分子与T细胞膜表面的PD-1特异性结合后抑制T细胞的活性和功能,进而促进肿瘤细胞逃避免疫系统的监视。因此,靶向PD-L1与PD-1两者相互作用的抗体具有阻碍肿瘤细胞免疫逃逸的作用。目前这种策略在部分癌症中取得了较好的临床治疗效果,但大多数患者对PD-1/PD-L1抗体阻断疗法仅显示15%-25%的有效率。所以,系统地揭示调控PD-L1表达水平的分子机制有助于进一步寻找提高临床疗效的策略。
该研究鉴定了一个新的PD-L1的正向调控因子去泛素化酶OTUB1,揭示了OTUB1 通过维持PD-L1蛋白的稳定性来调控肿瘤免疫的分子机制。OTUB1与PD-L1的胞内区段(ICD)特异性结合,依赖于其去泛素化酶的活性直接去除PD-L1 Lys-48连接的多聚泛素链,阻碍PD-L1蛋白在内质网的降解(ERAD)。OTUB1的缺失导致PD-L1蛋白的减少使得其与肿瘤表面的PD-1结合减少,并明显增强了肿瘤细胞对免疫细胞(PBMCs)杀伤作用的敏感性。在4T1乳腺癌小鼠模型中,进一步证明OTUB1能够正向调控PD-L1的蛋白水平,敲低OTUB1显著增强小鼠的抗肿瘤免疫反应。生物信息学分析以及人类乳腺癌(BRCA)临床病例的免疫组化分析结果显示,OTUB1与PD-L1的丰度呈正相关,OTUB1的高表达与乳腺癌患者预后差呈现显著相关性,表明OTUB1在未来乳腺癌患者的预后诊断中可作为分子标志之一。
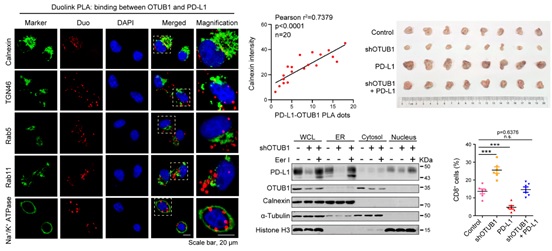
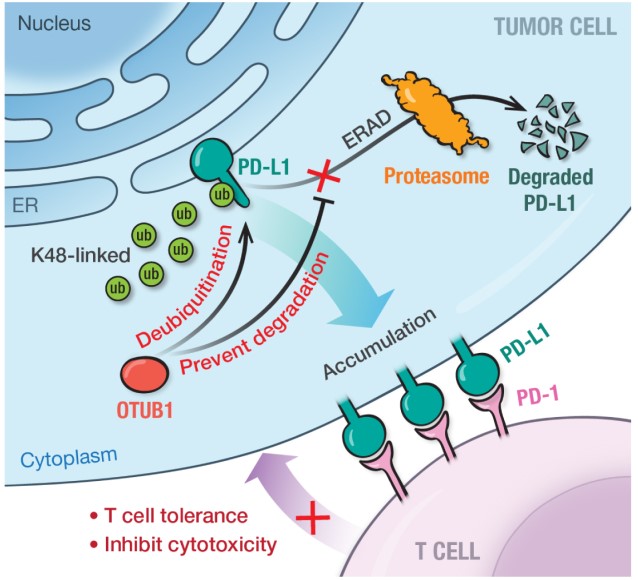
OTUB1通过阻碍PD-L1内质网降解调控肿瘤免疫抑制
该研究首次报道了去泛素化酶如何在内质网中调控PD-L1蛋白的丰度。内质网相关降解途径不仅能通过降解错误修饰或错误折叠的蛋白来调控内质网蛋白的质量,还可以参与对PD-L1等蛋白丰度的调节。本研究进一步揭示去泛素化酶OTUB1的生理作用,证明OTUB1在PD-L1糖基化之前保护其不被降解,参与ERAD对膜相关蛋白的数量调控,为深入了解PD-L1翻译后修饰与免疫逃逸的调控机理以及阐明PD-L1的功能提供有用信息。
北京大学郑晓峰课题组的博士研究生朱丹为Cell Death & Differentiation文章第一作者,郑晓峰教授为文章的通讯作者。北大生科院博士后徐瑞丹和博士生黄新平也在该课题中做出了重要贡献。该研究得到了国家科技部重点研发计划、国家自然科学基金重点项目、蛋白质与植物基因研究国家重点实验室、beat365官方网站、beat365官方网站仪器中心以及凤凰平台的大力支持。