检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
神经系统实现复杂行为背后,不同神经元之间如何进行有效地信息传递和整合,以及信息传递的异常是否导致特定疾病的发生,均是神经生物学领域的关键问题。乙酰胆碱作为经典的神经递质,是神经元之间信息沟通的关键媒介分子,其参与了生长发育、感知及运动、心血管功能、高级认知如学习记忆等诸多重要生理功能的调控 ADDIN EN.CITE ADDIN EN.CITE.DATA 1-3。由于神经系统的复杂性和乙酰胆碱的功能多样性,精确解析乙酰胆碱信号的动态变化,如特定神经元是否在行为的某个阶段释放或接收乙酰胆碱信号,可以帮助我们进一步了解乙酰胆碱的生理学意义。同时,探究乙酰胆碱信号在阿兹海默症、心血管疾病、肿瘤等疾病中的变化,也有助于探究和解析疾病的发病机理或临床症状的成因。
2020年9月28日,北京大学李毓龙实验室和北京脑科学与类脑研究中心井淼实验室合作,在Nature Methods杂志以Article形式在线发表了题为“An optimized acetylcholine sensor for monitoring in vivo cholinergic activity”的研究论文,报道了新一代高灵敏乙酰胆碱荧光探针的开发及其在多种模式生物中的成功应用。
应用光学成像的方法检测乙酰胆碱等神经递质在近年来取得了巨大的突破,这主要得利于新型荧光探针的开发及其广泛应用。自2018年起,北京大学李毓龙等课题组首次应用G蛋白偶联受体(GPCR)作为蛋白骨架,构建了一系列可以精确检测神经递质动态变化的荧光探针,即GPCR-Activation Based (GRAB)探针 ADDIN EN.CITE ADDIN EN.CITE.DATA 4-7。结合光学成像手段,GRAB探针系列目前已在多项工作中成功实现了神经递质信号及其功能在活体动物中的进一步解析 ADDIN EN.CITE ADDIN EN.CITE.DATA 8-10。在本工作中,研究者基于已发表的第一代GRAB乙酰胆碱探针进一步进行突变筛选和理性设计,成功获得了对乙酰胆碱具有约300%荧光信号响应的新版本探针(ACh3.0),其在信号幅度上相比第一代探针有3倍以上的提升,且仍保持着对乙酰胆碱的分子特异性和亚秒级的动力学特性。更重要的是,通过对探针进行设计和优化,ACh3.0探针在结合乙酰胆碱后不会激活内源的信号通路,这使得探针可以安全地作为“检测器”表达于细胞上,而不会对细胞本身的生理功能带来影响。综合而言,新版本的探针在检测乙酰胆碱方面兼具了细胞特异性表达、高灵敏性、高亲和力、快速反应速率以及高选择性,这为其在活体内精确解析乙酰胆碱的动态变化奠定了基础。

图一:新一代乙酰胆碱探针的开发及其刻画。
a: 针对乙酰胆碱探针的关键位置进行突变筛选成功获得新一代探针ACh3.0,其在信号幅度和基础亮度上都显著优于已发表的ACh2.0探针。同时,针对受体结合乙酰胆碱位点的突变获得对照探针ACh3.0-mut,可在活体应用中作为阴性对照证明乙酰胆碱信号的特异性。
b: 不同版本乙酰胆碱探针在培养的HEK293T细胞中的表达情况及其对乙酰胆碱的荧光响应。
在对乙酰胆碱探针进行优化和一系列刻画后,研究团队进一步在多种模式生物中应用了探针,并成功地检测了内源的乙酰胆碱在不同脑区的释放及其调控。如在转基因果蝇中研究团队揭示了活体果蝇在接受不同生理刺激时,嗅觉中枢蘑菇体存在区域特异性的乙酰胆碱释放。在活体小鼠中,研究者成功记录到了在包括杏仁核、海马、皮层等不同脑区中,多种行为过程中乙酰胆碱的动态变化,这将对进一步研究乙酰胆碱的生理和病理功能提供重要工具。
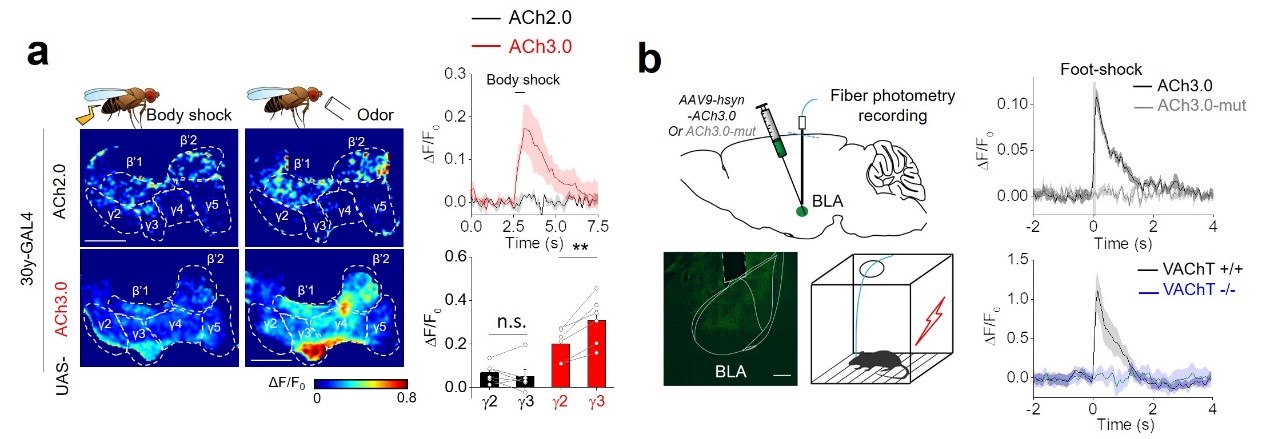
图二:新一代乙酰胆碱探针在果蝇及小鼠中的成功应用。
a: 应用新一代乙酰胆碱探针ACh3.0观测到活体果蝇嗅觉中枢中,特定生理刺激引发的区域特异性乙酰胆碱信号变化。其中,ACh3.0相比于ACh2.0具有明显提高的活体检测灵敏度。
b: 新一代乙酰胆碱探针ACh3.0记录到小鼠基底外侧杏仁核(BLA)处在小鼠受到电击刺激时的乙酰胆碱释放。研究者应用对照探针ACh3.0-mut或特异性敲除乙酰胆碱囊泡转运体VAChT的小鼠作为对照,证明检测到的荧光信号为乙酰胆碱浓度变化导致。
北京脑科学与类脑研究中心的井淼博士为本文章的第一作者,井淼博士与北京大学李毓龙博士为文章的共同通讯作者。北京大学已毕业本科生李玥璇及CLS项目博士生曾健智、钱统瑞、潘孙磊等对文章做出了重要贡献。国内外合作团队包括中科院神经科学研究所徐敏实验室、华中科技大学李浩洪实验室、北京大学分子医学研究所陈良怡实验室和程和平实验室、加拿大西安大略大学Marco Prado, Lisa Saksida, Vania Prado和Tim Bussey实验室,以及美国南加州大学Andrew Hires实验室。该研究受到北京大学膜生物学国家重点实验室、国家自然科学基金、美国脑计划、脑科学与类脑研究北方科学中心地方配套科研项目等支持。
原文链接:https://www.nature.com/articles/s41592-020-0953-2
参考文献:
1. Dale, H.H., Feldberg, W. & Vogt, M. Release of acetylcholine at voluntary motor nerve endings. The Journal of Physiology 86, 353-380 (1936).
2. Winkler, J., Suhr, S.T., Gage, F.H., Thal, L.J. & Fisher, L.J. Essential role of neocortical acetylcholine in spatial memory. Nature 375, 484-487 (1995).
3. Brezenoff, H.E. in Federation proceedings, Vol. 43 17 (1984).
4. Jing, M. et al. A genetically encoded fluorescent acetylcholine indicator for in vitro and in vivo studies. Nature biotechnology 36, 726-737 (2018).
5. Sun, F. et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell 174, 481-496 e419 (2018).
6. Patriarchi, T. et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science 360 (2018).
7. Feng, J. et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Vivo Detection of Norepinephrine. Neuron 102, 745-761 e748 (2019).
8. Tanaka, M., Sun, F., Li, Y. & Mooney, R. A mesocortical dopamine circuit enables the cultural transmission of vocal behaviour. Nature 563, 117-120 (2018).
9. Peng, W. et al. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science 369 (2020).
10. Zhang, X., Noyes, N.C., Zeng, J., Li, Y. & Davis, R.L. Aversive Training Induces Both Presynaptic and Postsynaptic Suppression in Drosophila. The Journal of Neuroscience 39, 9164-9172 (2019).