检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2020年8月18日,beat365官方网站蒋争凡实验室与苏晓东实验室合作在国际著名学术期刊《Cell Reports》上以Research Article形式在线发表了他们在天然免疫研究领域的最新成果——Mn2+ Directly Activates cGAS and Structural Analysis Suggests Mn2+ Induces A Noncanonical Catalytic Synthesis of 2’3’-cGAMP。
天然免疫通过模式识别受体感知病原体入侵,激活下游反应抵抗病原体感染。cGAS是胞质DNA受体,双链DNA结合后,别构激活cGAS,以镁离子(Mg2+)为催化辅因子,以ATP和GTP为底物合成环二核苷酸第二信使2’3’-cGAMP,进一步激活接头蛋白STING(MITA/ERIS),最终诱导I-型干扰素等细胞因子产生。此外,cGAS也会被泄露到细胞质的自身DNA激活,在抗肿瘤免疫,自身免疫病,细胞损伤及衰老等过程中发挥重要作用。2018年,蒋争凡课题组发表在《Immunity》的工作发现,锰离子(Mn2+)对宿主感染病毒后cGAS-STING通路的活化有重要作用,病毒感染导致线粒体、高尔基体等细胞器中贮存的Mn2+向胞浆中释放并累积,进而强烈促进cGAS-STING通路激活,然而,Mn2+激活cGAS-STING通路的具体机制并不清楚。
在本研究中,蒋争凡课题组首先通过生化实验发现,Mn2+可强烈激活原核纯化的人cGAS合成2’3’-cGAMP;DNA结合位点突变的cGAS不再被dsDNA激活,但依然能被Mn2+强烈激活,证明Mn2+可以不依赖DNA直接激活cGAS。有趣的是,DNA激活cGAS时依赖cGAS二聚化,破坏该二聚体界面的cGAS突变体不能被DNA激活,却依然能被Mn2+激活,进一步证明Mn2+不依赖DNA激活cGAS,并暗示Mn2+激活cGAS的机制与dsDNA激活不同。与此相应,cGAS催化三联体突变完全不能被DNA+Mg2+激活,却依然被Mn2+激活。这些结果证明Mn2+是cGAS激活剂,可直接激活cGAS,进而合成第二信使2’3’-cGAMP。
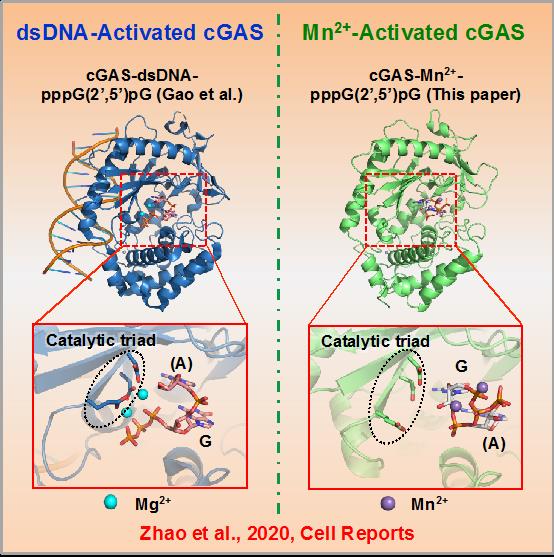
随后,蒋争凡实验室与苏晓东实验室合作,解析了Mn2+激活的小鼠cGAS的三个不同催化状态的高分辨率晶体结构,发现:1)Mn2+-cGAS结合导致的构象变化与dsDNA-cGAS结合类似,但关键的“activation loop region”在Mn2+-cGAS中呈现独特的变化;2)Mn2+激活的cGAS合成2’3’-cGAMP的步骤与DNA-Mg2+激活时一致:先产生二核苷酸线性中间体pppG(2’5’)pA,再进行分子内环化形成2’3’-cGAMP;3)然而,Mn2+激活的cGAS,线性中间体与cGAS催化口袋结合方式与DNA激活的中间体结合方式相反,提示Mn2+激活的cGAMP合成不需要底物在催化口袋中进行两次翻转(Flip-over),该结果可解释Mn2+激活cGAS时具有更高的cGAMP合成效率;4)更有趣的是,Mn2+激活cGAS中,两个Mn2+与二核苷酸中间体的5’-三磷酸基团结合,而不像Mg2+-底物那样,必需与cGAS催化三联体结合。这就解释了为什么催化三联体突变的cGAS依然能被Mn2+激活,而不被Mg2+激活。在DNA激活cGAS过程中,由于Mg2+-底物作用依赖催化三联体,底物必须在第一步反应后发生翻转,才能重新与催化三联体相互作用,进而发生第二步催化。因此,催化三联体非依赖的Mn2+结合也和底物不需要翻转相吻合。
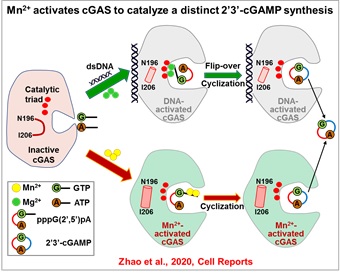
该研究发现并证明Mn2+是DNA以外的第二个cGAS激活剂,并催化一个不同寻常的cGAMP合成过程。这些发现拓展了对cGAS功能的认识,为进一步理解cGAS的激活与生理学功能提供了线索,同时也为设计新的cGAS激动剂提供了理论基础。更重要的是,cGAS属于核苷酸转移酶超家族(NTases),其成员包括DNA polymerase,OAS1,DncV,以及众多cGAS/DncV-like NTases;在结构上,几乎所有NTases都有类似的催化核心区域的三维结构。以往的生化研究发现,Mn2+代替Mg2+可显著增加许多NTases的酶活,但具体机制并不清楚;此外,许多cGAS/DncV-like NTases的激活机制与生物学功能仍未知。因此,该研究为进一步揭示Mn2+的生物学功能,尤其是对众多核苷酸转移酶激活与催化机制的研究提供了重要的参考。
生科院2018级博士生赵震、2017级本科生马知行和2016级博士生王博为论文的共同第一作者,生科院/北大--清华生命科学联合中心的蒋争凡教授及生科院的苏晓东教授为共同通讯作者。生科院已毕业学生管玉坤博士帮助了本项研究。本研究工作得到了国家自然科学基金委、科技部国家重点基础研究项目、北京大学“细胞增殖与分化”教育部重点实验室及“北大--清华生命科学联合中心”的资助。